Брутон також був першим лікарем, який здійснив специфічну імунотерапію цього Х-зчепленого розладу шляхом введення внутрішньом’язових ін’єкцій IgG. Стан пацієнта покращився, проте після сорока років у нього виникло хронічне обструктивне захворювання легень.
Патофізіологія
Зараз цей розлад також називають Х-зчепленою агаммаглобулінемією (X-linked agammaglobulinemia — XLA), а генний дефект виявлений в гені, який кодує тирозинкіназу Брутона (BTK) на смузі Xq21.3. Ген BTK великий і складається з 19 екзонів, що кодують 659 амінокислот, які утворюють BTK цитозольну тирозинкіназу. Мутації можуть відбуватися в будь-якій ділянці гена. BTK необхідний для проліферації та диференціації В-лімфоцитів.
За відсутності функціональної BTK, зрілі В-клітини, які експресують поверхневий Ig та маркер CD19, відсутні. Відсутність CD19 легко виявити за допомогою флюороцитометричних аналізів, і ця знахідка зазвичай легко підтверджує діагноз XLA в осіб чоловічої статі. Як спочатку описав Брутон, XLA проявляється у 80% випадків як пневмонія та інші бактеріальні синопульмональні інфекції. Такі інфекції, що починаються у немовлят чоловічої статі, коли материнські антитіла IgG, набуті трансплацентарно, втрачаються. Таким чином, XLA, найімовірніше, діагностується, коли у немовляти чоловічої статі молодше 1 року трапляються незвично важкі або рецидивуючі синопульмональні інфекції.
У деяких людей встановлення діагнозу затягується до зрілого віку. У деяких випадках цю затримку можна пояснити різним ступенем тяжкості XLA, навіть у сім'ях, у яких присутня однакова мутація. Однак суттєвим фактором, що сприяє, є погана запальна реакція, яка спостерігається за відсутності антитіл. Запізнілий діагноз ставить пацієнтів під загрозу хронічної легеневої хвороби та поганого росту, що призводить до смертності в молодшому віці.
За відсутності зрілих В-клітин у пацієнтів не вистачає лімфоїдної тканини і не вдається розвинутися плазматичним клітинам — тобто клітинам, що виробляють антитіла. Зародкові центри, де В-клітини розмножуються і диференціюються, слабо розвинені у всій лімфоїдній тканині, включаючи селезінку. Мигдалини, аденоїди, периферичні лімфатичні вузли та плями Пейєра в кишечнику — є невеликими або відсутні. У легенях і кишечнику відсутній нормальний розподіл лімфоцитів. Однак біопсія дослідження лімфоїдної тканини та кісткового мозку в даний час не проводиться в при обстеженні в більшості випадків XLA.
Епідеміологія
Орієнтовна народжуваність з XLA у США була розрахована як 1 випадок на 379 000 живонароджених. У Сполучених Штатах оцінюється поширеність 1 випадку на 250 000 осіб. Однак ця кількість була розглянута до того, як стало доступним мутаційне тестування, і, як правило, вважається заниженою. Вважається, що нові мутації спричиняють 30-50% випадків XLA.
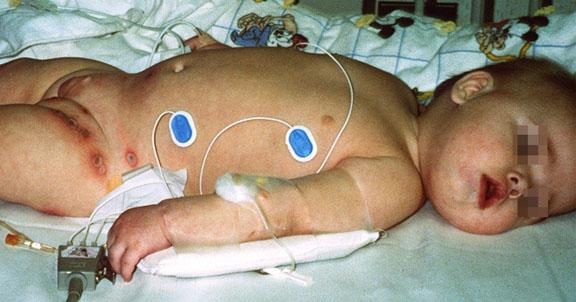
![Bruton agammaglobulinemia (ie, X-linked agammaglobulinemia [XLA]) in brothers](/sites/default/files/inline-images/42492.jpg)
Смертність
Пацієнти, які отримували внутрішньовенно IgG (IVIG) до віку 5 років, мають нижчі показники захворюваності та смертності, ніж раніше виявлені пацієнти, які отримували лікування лише свіжозамороженою плазмою (FFP) та внутрішньом’язовим Ig (IMIG); досягти рівня IgG близько норми або навіть вище 200 мг/дл складно за допомогою FFP або IMIG. Пацієнти, які регулярно отримують терапію IVIG або підшкірний IgG (SCIG), можуть мати майже нормальний спосіб життя. Відомо, що пацієнти можуть жити до сімдесяти років.
Вірусні та легеневі інфекції спричиняють понад 90% смертності.
Хронічні ентеровірусні інфекції є найбільш поширеною етіологією ранньої захворюваності. Високі дози IVIG, уповільнюють, але не припиняють, прогресування погіршення функції ЦНС. Деменція, атаксія та парестезії є загальними клінічними ознаками менінгоенцефаліту, спричиненого ентеровірусами. Інші вірусні причини смерті є спорадичними. Аденовіруси є загальновизнаними причинами захворюваності та смертності у будь-якого пацієнта з ослабленим імунітетом.
До загальних збудників належить S pneumoniae, H influenzae type b, and Staphylococcus aureus. Burkholderia cepacia та coagulase-negative staphylococci є також важливими збудниками.
За наявності запального захворювання кишечника, як правило, хронічний характер XLA і призводить до гіпотрофії та кахексії, а також збільшує ризик інфекції. Інші аутоімунні розлади, такі як артрит, можуть бути особливо інвалідизуючими. Для пацієнтів з цими ускладненнями обстеження на наявність бактерійних збудників є важливим, оскільки лікування імунодепресивними препаратами може ускладнити лікування.
Стать
XLA — це розлад, який вражає лише чоловіків. Жодної жінки-носія з будь-яким клінічним захворюванням, пов’язаним з мутованим алелем, не виявлено.
Оскільки XLA є генетичним розладом, немовлята чоловічої статі можуть бути обстежені за допомогою пренатальної діагностики, коли мати є носієм. Відбір проб ворсин хоріону (CVS) можна проводити на початку вагітності, а також аналіз ДНК можна використовувати, коли відома точна мутація в сім'ї. Амніоцентез можна проводити пізніше в період гестації. Збір фетальних лімфоцитів за допомогою внутрішньоутробного відбору проб з пуповини може бути використаний для переліку CD19 + В-клітин та зрілих Т-клітин за допомогою флуороцитометричного аналізу, хоча ця процедура ставить плід під певний ризик смертності (від <1-5%). При народженні пуповинну кров можна направити на флюороцитометричний аналіз популяцій лімфоцитів. Кількісний рівень IgG не є важливим, оскільки рівень IgG у плода значною мірою відображає материнський IgG, що транспортується через плаценту.
Через пасивне трансплацентарне перенесення материнських IgG у новонароджених нормальний рівень IgG у сироватці крові, і вони можуть не мати проблем, поки IgG не катаболізується. Оскільки новонароджені не можуть виробляти власний Ig, підвищена сприйнятливість до інфекцій зазвичай розвивається у немовлят старше 6 місяців. Отже, пацієнти з XLA можуть клінічно проявлятись у віці від 3 місяців до 5 років. Зараз більшість випадків XLA виявляються у пацієнтів молодше 1 року, залежно від швидкості втрати IgG від матері та виникнення інфекцій. Середній вік діагнозу молодший у пацієнтів із сімейним анамнезом (2,6 роки), ніж у пацієнтів без нього(5,4 роки).
Пацієнти можуть також спостерігатись у другому або третьому десятилітті життя, хоча це трапляється рідко. Найстарший вік на момент встановлення діагнозу — 51 рік. У цих пацієнтів може бути легший прояв захворювання, пов’язаний з наявністю мутованого білка BTK, а не повна відсутність білка. В рідкісних випадках людина страждає легкою формою захворювання, тоді як інші з такою ж мутацією мають більш серйозні клінічні захворювання.
The non-governmental organization INgenius is a Ukrainian-language medical platform that has been promoting evidence-based medicine among the community of doctors in Ukraine since 2016. Our team has created an open database of translated treatment protocols, analytical articles on reliable treatments, and analysis of fuflomycins. We also organize events for doctors on a highly professional level.
If you want even more evidence-based Ukrainian-language content, more interesting experiments, and practical activities, support us with the help of donors!
The funds raised will be spent on:
- technical support of the site;
- the monthly payment for platforms such as ZOOM, telegram, etc.;
- payment for a designer;
- free events;
- advertising.
Each of your contributions is a contribution to the future not only of our platform but also of the progressive development of evidence-based medicine in Ukraine.
Revolution in you!
ingeniusua@gmail.com
